当社は株式会社SCREENホールディングスのグループ会社です。
アプリケーション
MED64システムは神経、心臓、骨格筋等の興奮性細胞が発する電気活動を細胞外電位として取得します。これまでに約350報(2017年11月弊社調べによる)の論文で使用されており、代表的な脳スライス標本での応用のみならず、近年ではiPS細胞由来心筋細胞・神経細胞での応用も増えています。
急性脳スライス標本1-誘発電位
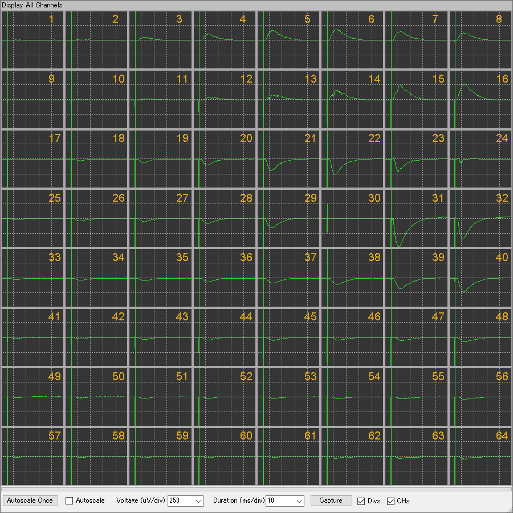
MED64システムの代表的な応用事例が急性脳スライス標本での誘発電位計測です。特に海馬や大脳皮質でのLTP(long term potentiation、長期増強)試験については豊富な実績があります。LTPは一定の刺激強度により数十秒間隔で経時的に取得する誘発電位の大きさ(ベースライン応答)が、テタヌス刺激やシータバースト刺激とよばれる特殊なパターンの刺激を与えた後に持続的に増大する現象です。

- MED プローブ(MED-P515A)上のマウス海馬脳スライス標本。CA3野からCA1野の錐体細胞へと投射するシャッファー側枝を刺激して、放線層で錐体細胞の樹状突起と形成されるシナプスからの誘発応答を計測する。本例ではch30、ch32を通過するシャッファー側枝を20秒ごとに交互に刺激して、ch31で誘発される電位に焦点を当てる。たとえ同じ電極上であっても、ch30、ch32を刺激して興奮するシャッファー側枝が異なるため、ch31のそれぞれの誘発電位は質的に異なる(電極周辺で興奮するシナプスが異なる)。
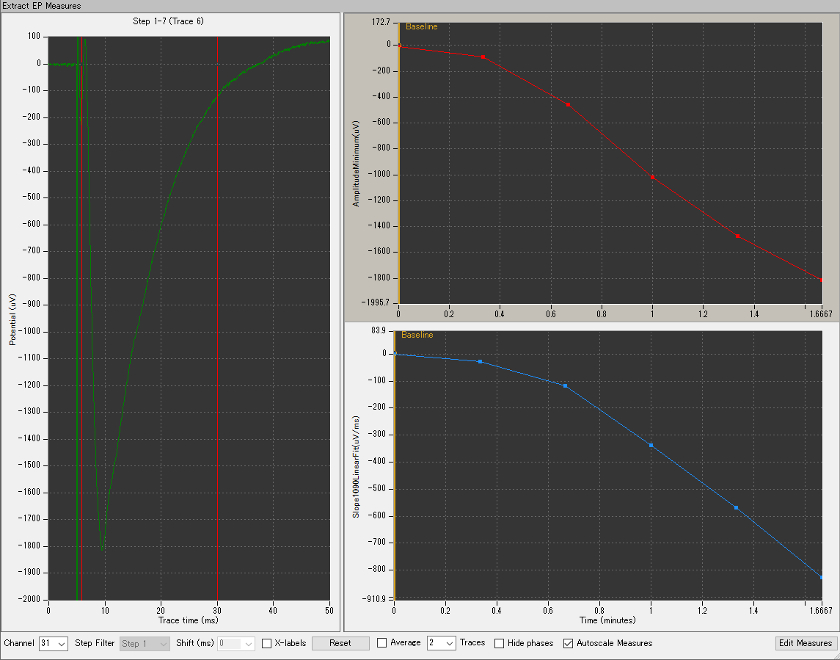
- IOカーブの計測。誘発電位の大きさ(立ち下がり部分の傾きや振幅)は、標本と電極の密着具合に依存する。それにより、標本ごとに大きさに人工的なばらつきが生じるため、その絶対値を統計量として扱うことは不適切である。そこで、段階的に刺激強度を増加させて得られる誘発電位の応答曲線を得てその最大応答の30%応答の刺激強度をテスト刺激とし、誘発電位のベースライン応答を得る。LTPはベースライン応答を100%としたときの増強率で評価される。
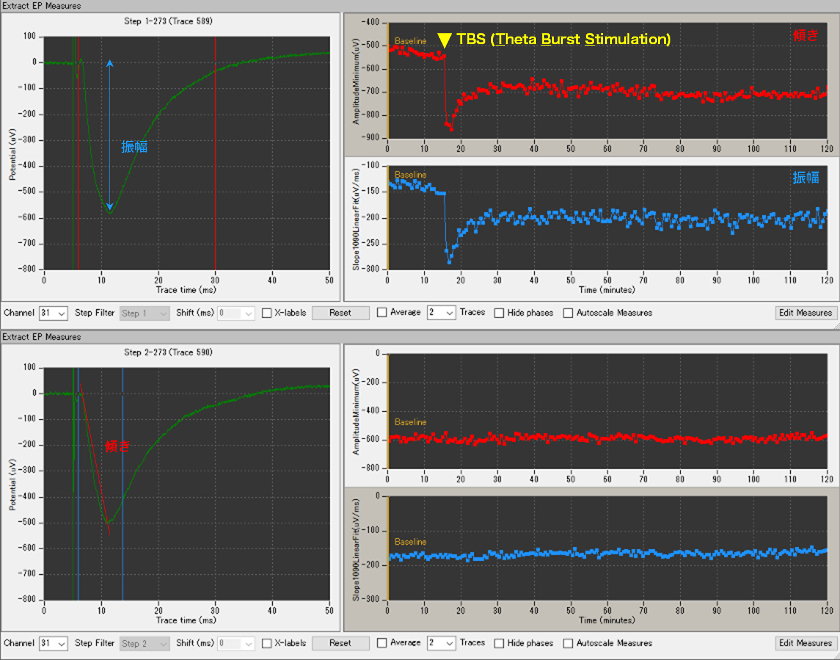
- 上段がch30、下段がch32を刺激した際のch31の誘発電位。ch30ではテスト刺激を15分間適用した後、2秒間のシーターバースト刺激を適用、その後のテスト刺激でのベースライン応答が約2時間増強、持続している。

- データ元
アルファメッドサイエンティフィック株式会社
急性脳スライス標本2-オシレーション
急性脳スライス標本の応用事例として、LTP試験に次いで多く取り組まれているのがオシレーション計測です。オシレーションは神経回路網がさまざまな周期で同調的に活動することによって発生する局所電場電位(LFP; local field potential)です。薬物の灌流投与や電気刺激等により誘発することができ、その発生機構の神経生理学的研究や学習・記憶、てんかん等の現象についての薬理学的、病態生理学的研究に応用されています。

- MED プローブ(MED-P530A)上のマウス海馬脳スライス標本。海馬において、自発的な鋭波が発生しやすくなるよう、吻側が尾側に対して水平方向より12.7°高くなるように傾けて横断スライス標本を作成した。鋭波は記憶の固定に関与すると考えられており、海馬CA3領域で発生して海馬CA1へと伝搬する。赤枠で示す海馬CA3領域で発生した鋭波を解析対象とした。
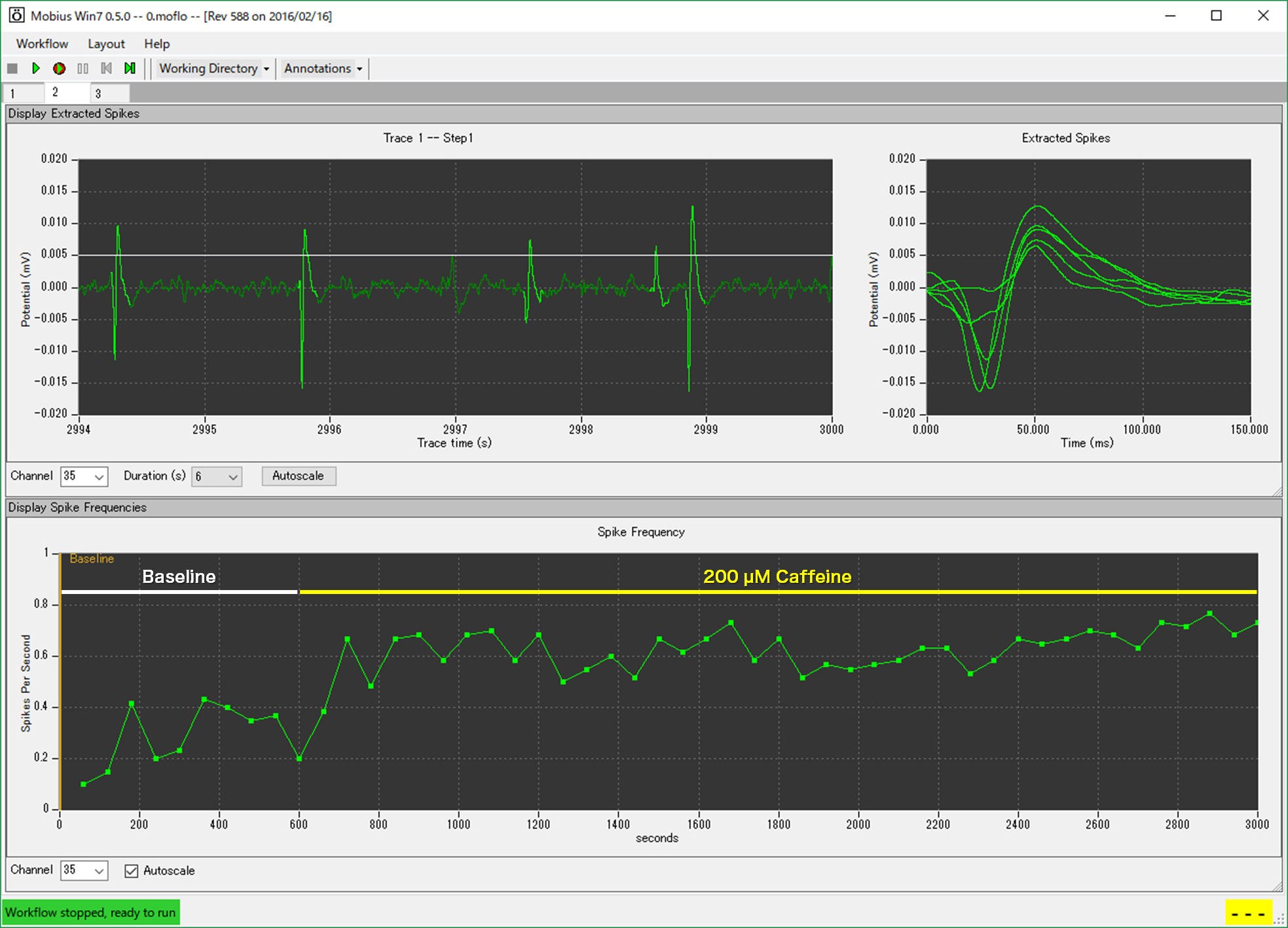
- 2-30 Hzでのバンドパスフィルタリング処理を適用し、ベースラインノイズの5倍SD値を超える信号を鋭波として検出。 Adenosine受容体の非選択的アンタゴニストでもあるCaffeineの灌流適用は、濃度依存的に鋭波の発生頻度を増加させた。
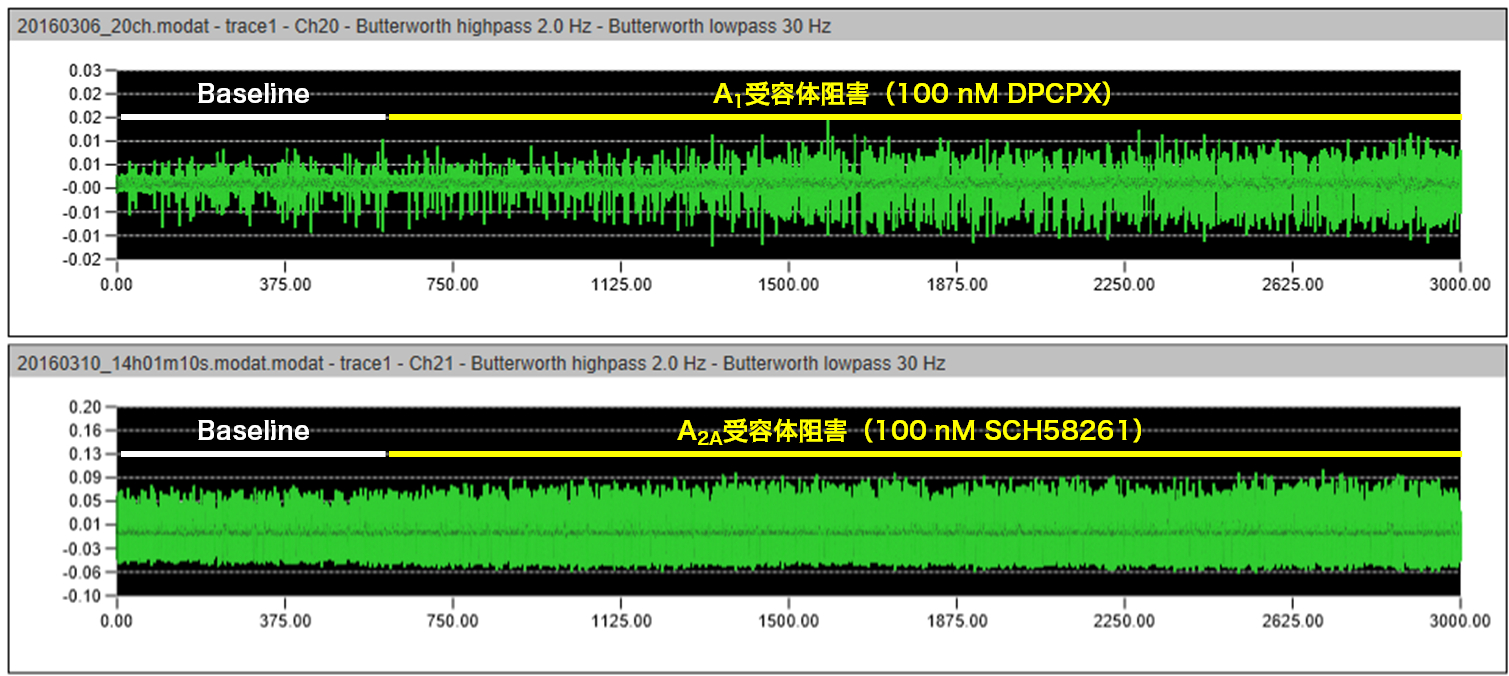
- Adenosine A1受容体選択的アンタゴニストは鋭波の発生頻度を増加させ、選択的アゴニストは発生頻度を減少させた。 また、Adenosine A2A受容体選択的アンタゴニストは発生頻度に影響しなかった。さらにAdenosine A1受容体選択的アゴニストによる発生頻度減少作用はCaffeineにより拮抗された。
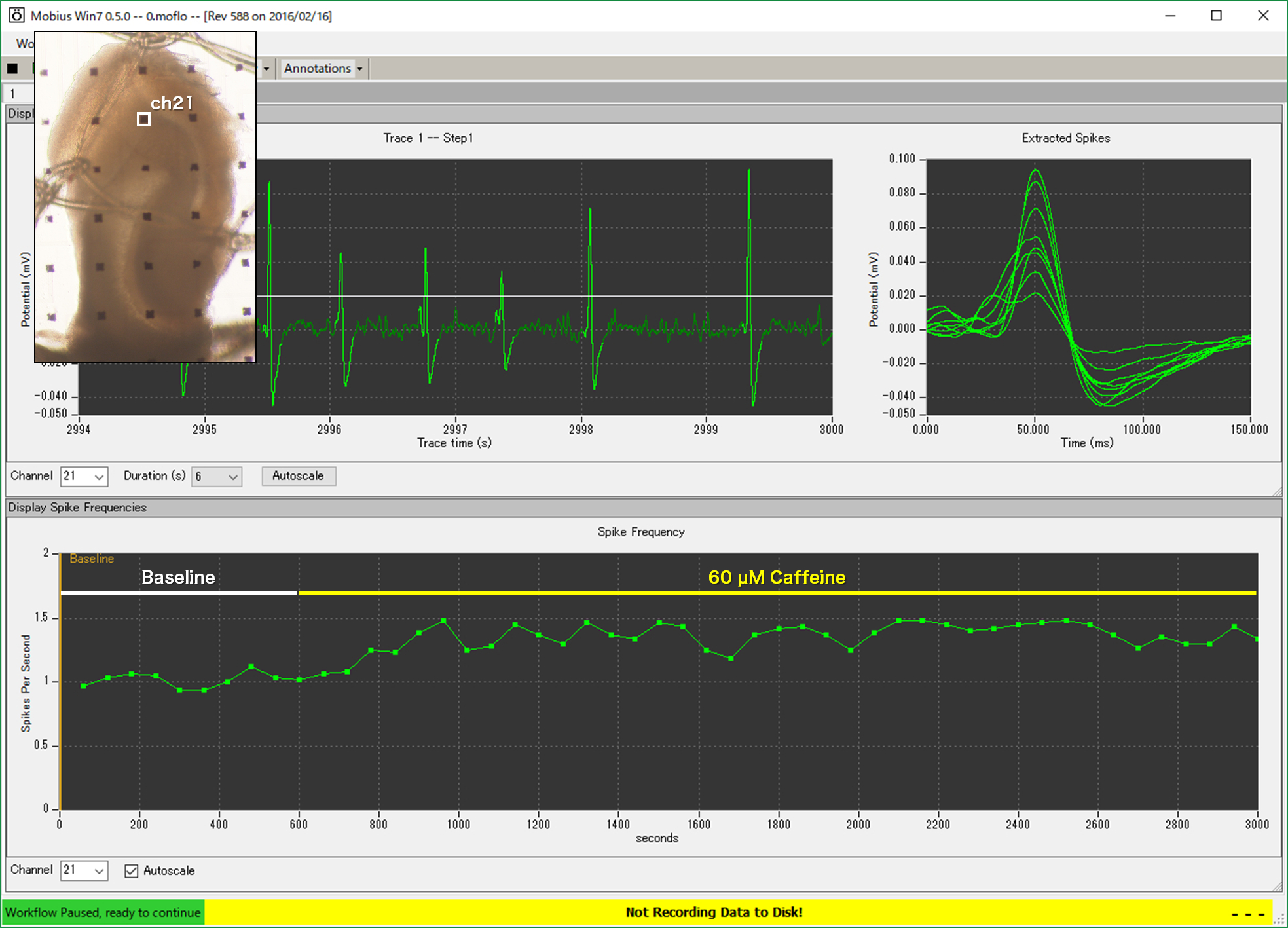
- 歯状回-CA3領域のみにトリミングした標本においても、Caffeineの灌流適用によって鋭波の発生頻度の増加が認められた。Caffeineによる鋭波の発生頻度の増加は、CA3領域のAdenosine A1受容体拮抗作用によるものと考えられる。

- データ提供
渡邉 裕亮 様、池谷 裕二 教授
東京大学大学院薬学系研究科 薬品作用学教室

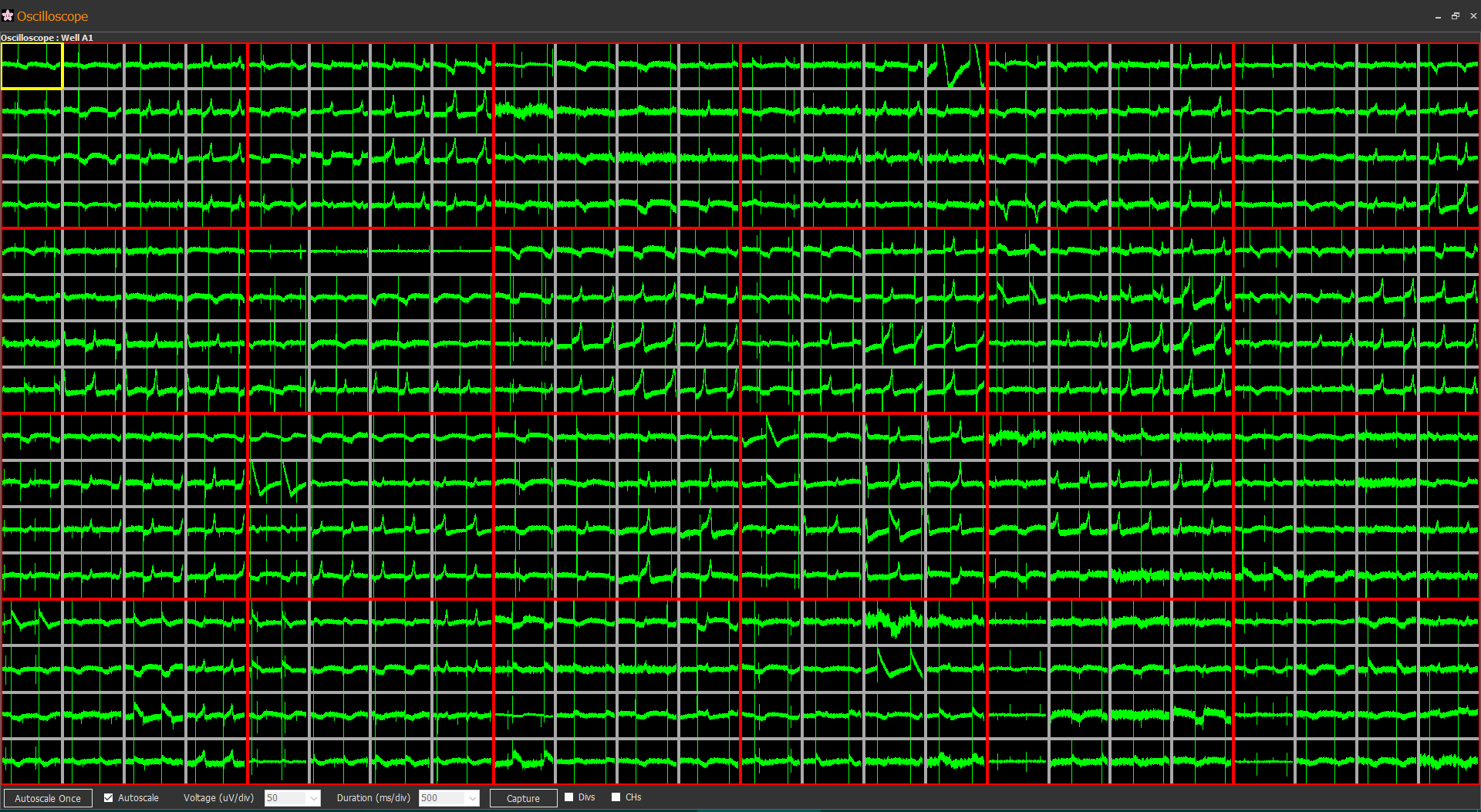
- MED プローブ(MED-P515A)上のマウス海馬脳スライス標本。薬剤の灌流適用により誘発されるてんかん様波形を検出する部位として、皮質と海馬の境界領域(海馬白板)に位置するチャンネルをその標本を代表するデータとして任意に選んだ。
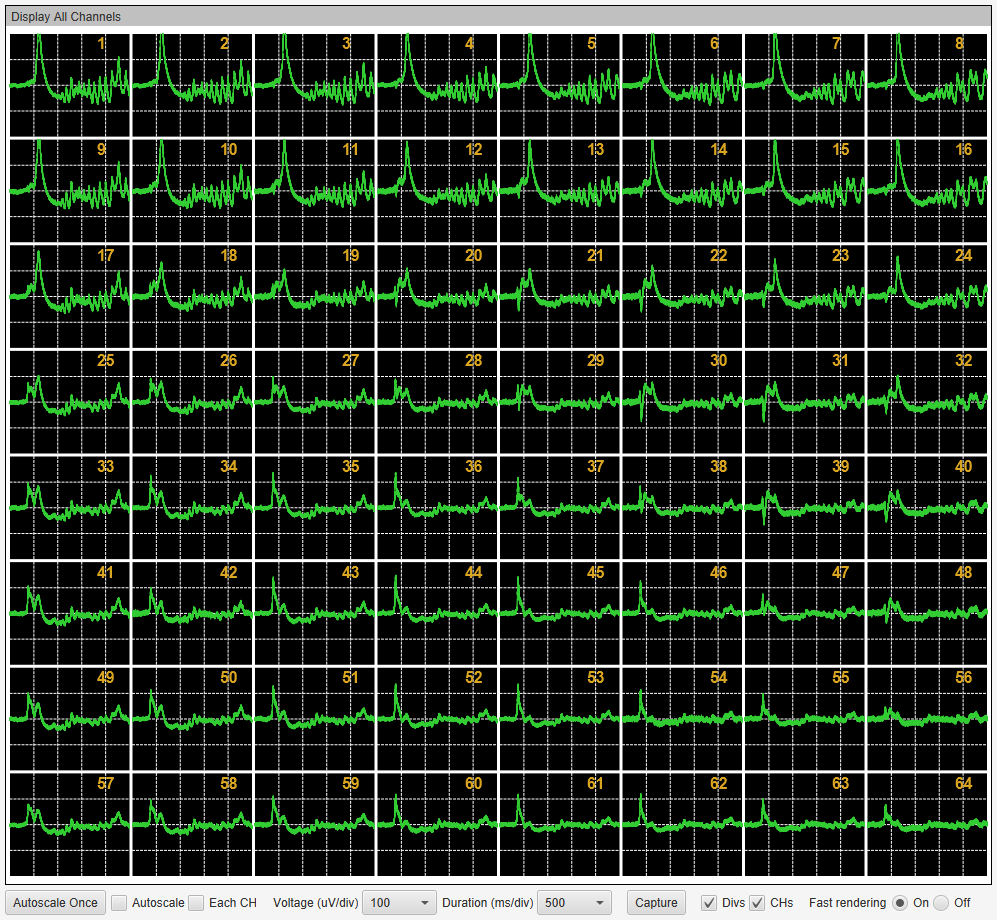
- てんかん陽性または陰性薬剤として14種類の試験化合物を5段階の用量で漸増的に灌流適用し、各用量につき10分間のデータ収録を行った。 本例はPicrotoxin適用により誘発されたてんかん様波形の64チャンネル画面表示。

- 各用量での10分間の計測区間のうち、2~9分の区間を解析対象とした。50 ms間隔ごとの区間を微分し、傾きが0.1 uV/msを超えるピーク点を検出。ピーク点を基準として、-200 ms~2070 msの範囲をてんかん様波形として抽出した。
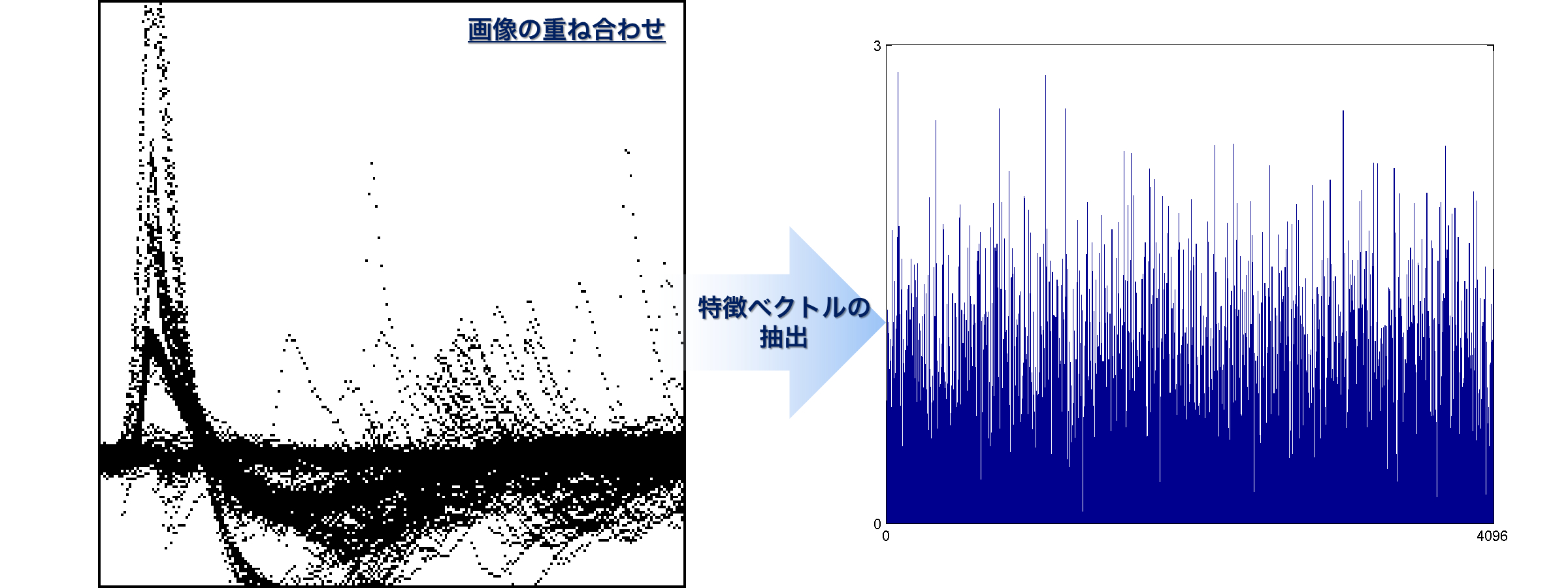
- てんかん様波形を227×227 pixcel(1uV/px × 0.01s/px)の画像に変換。各用量ごとに検出した全てのてんかん様波形の変換画像を単一の画像として重ね合わせた。 深層学習のオープンソースフレームワークであるCaffeを用いて重ね合わせ画像から4096次元の特徴ベクトルを抽出し、PCAベースの線形SVMでの入力特徴として用いた。
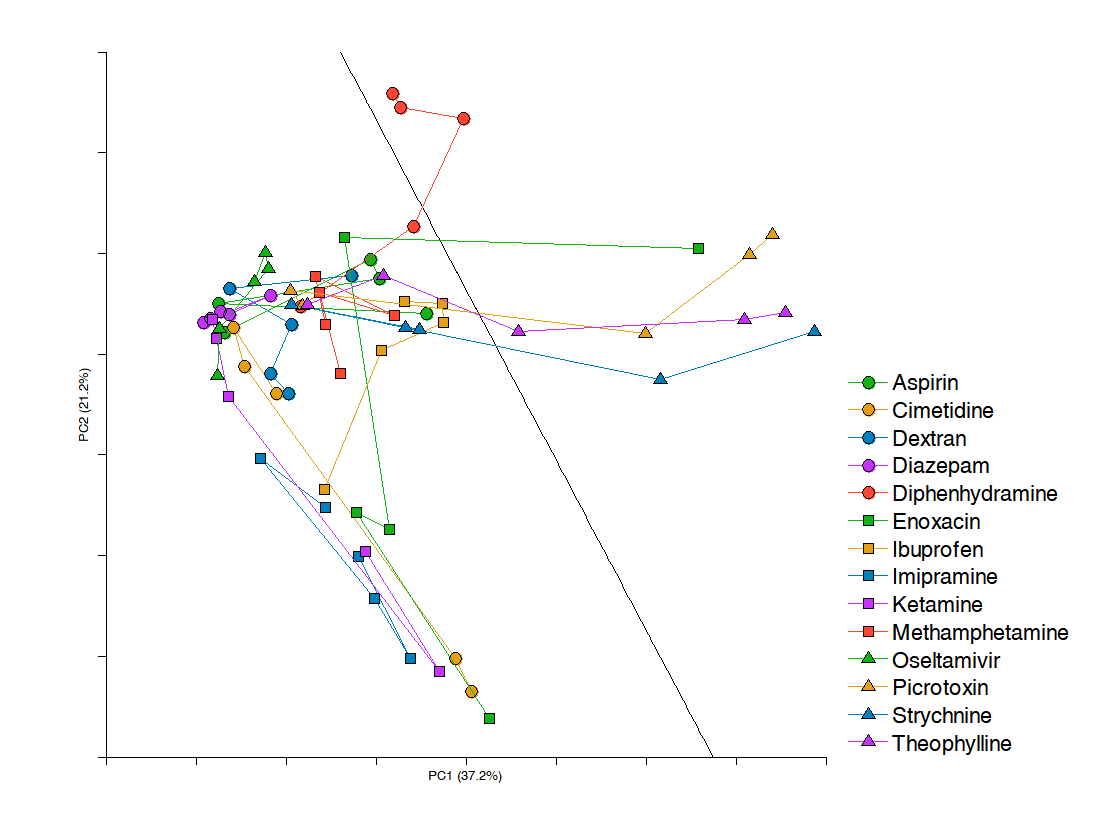
- 4096次元の特徴ベクトルを主成分分析によって次元削減し、第1、2主成分の空間にプロット。各薬剤の各用量を1つのデータ点としてプロットし、同一薬剤ごとにデータ点を直線で結んだ。SVMにより決定された境界線によりてんかん作用を示す薬剤、用量を境界線右側の空間に分類した。この境界線は新たに評価した既知の試験化合物についても精度良く分類できた。

- データ提供
高 梦璇 様、池谷 裕二 教授
東京大学大学院薬学系研究科 薬品作用学教室
培養神経回路網
MED プローブの記録電極エリアに神経細胞の懸濁液を播種し、培養を続けると、神経細胞同士が自律的に回路網を形成し、外部からの信号入力がない状態でも自発活動を生じるようになります。その自発活動は脳部位ごと、電極ごとに 緊張性(持続性)発火やバースト発火等の異なるパターンを示し、培養日数が経過することでその出現頻度や持続時間、パターン等が変遷していきます。この現象は胎児期の生体内での神経回路網の発達過程をin vitroで再現していると考えられますが、近年ではこれらの標本を化合物の薬効や毒性の評価対象とする試験法の開発が進んでいます。
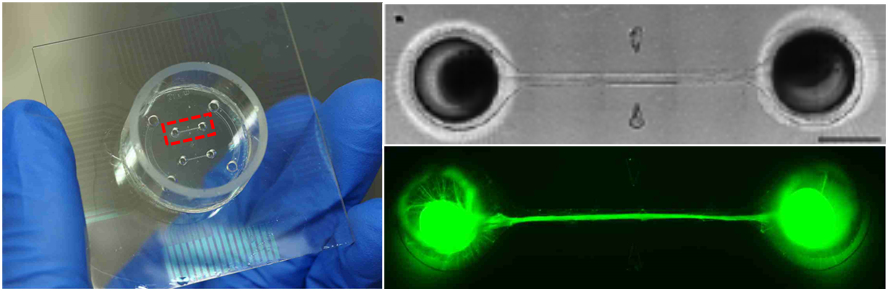
- 16電極 (4×4配列) が離れた4つのエリアに配置されたMED プローブ上に微小流路デバイスを搭載した。大脳オルガノイドを各電極エリアに播種し、流路を通じて相互の神経支配を促し、Connected organoid(連結オルガノイド)を作成した。物理的に離れた脳領域間での信号伝達をオルガノイドでモデル化した。
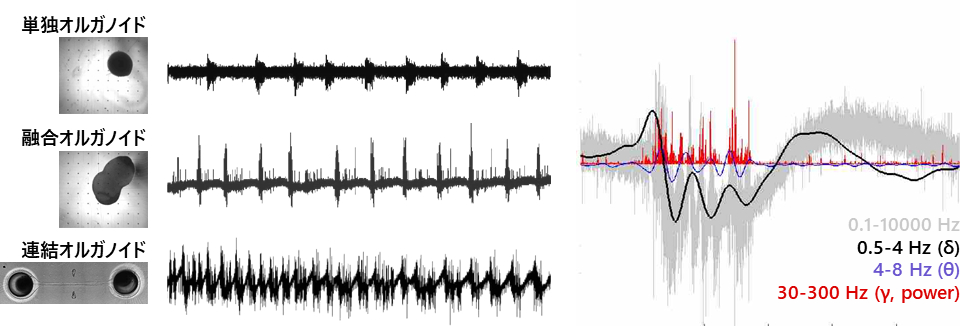
- 連結オルガノイドは単独のオルガノイドや、細胞数が同一のFused organoid (融合オルガノイド) よりも、複雑で活発な神経活動を示した。この結果は物理的に離れたオルガノイドを機能的に連結する軸索束を介した信号伝達が、活動パターンの形成に重要であることを示している。また、この活動にはヒト未熟児の脳波に相似した“オシレーション(神経律動)とよばれる低帯域の活動成分が認められたが、単独のオルガノイドよりも比較的早期 (9週間) に観察された。
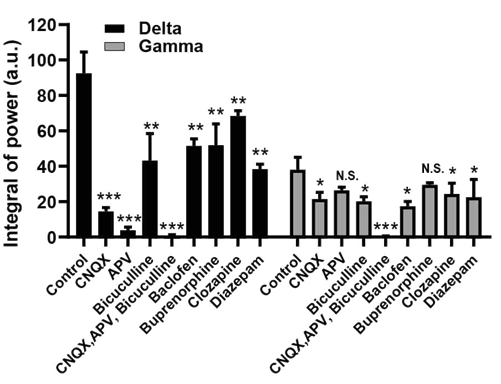
- 連結オルガノイドの神経活動をスパイク検出数や同期バースト頻度、ウェーブレット変換によるデルタ帯域(0.5-4 Hz)及びガンマ帯域(30-300 Hz)のパワー等で定量化した。これらの指標はグルタミン酸及びGABAの各種リガンド処置によって一貫性のある影響を受けたことから、 連結オルガノイドを対象とした化合物評価の可能性を示した。
- データ提供
大﨑 達哉 特任助教、池内 与志穂 准教授
東京大学 生産技術研究所
培養心筋細胞
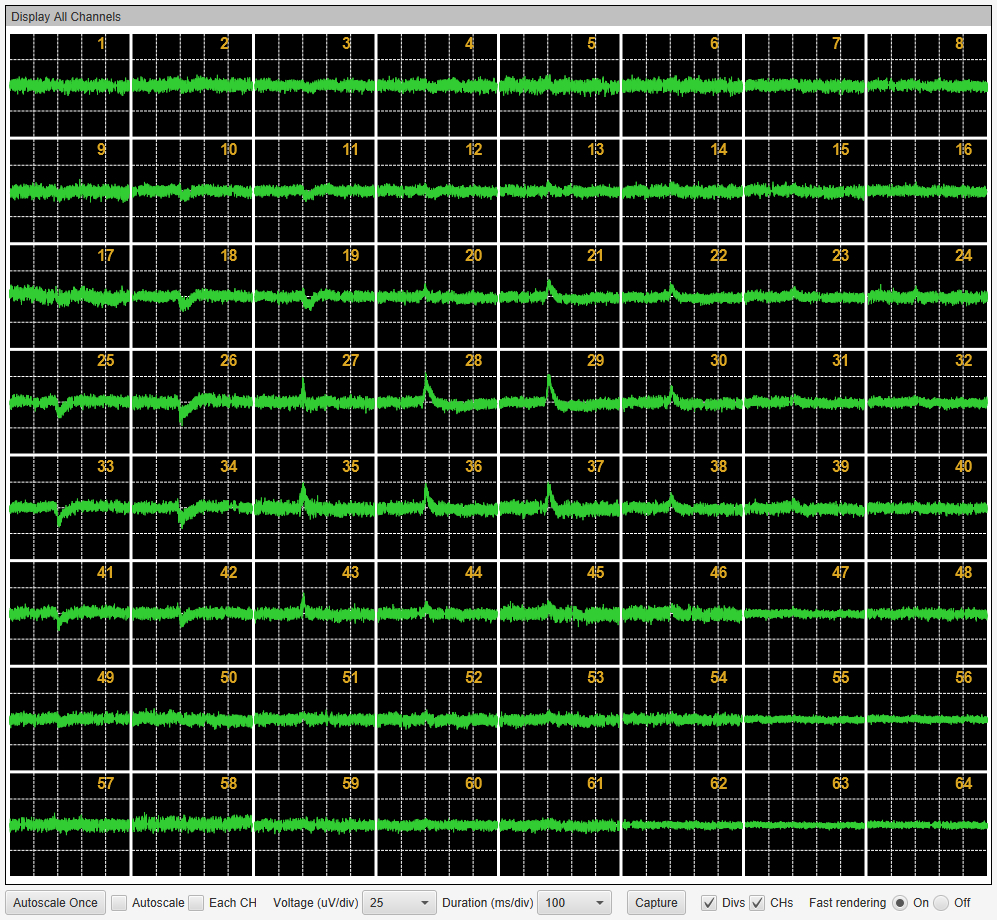
心筋細胞の単層シート様培養標本は、1拍動ごとに特徴的な細胞外電位波形を示します。1stピーク、2ndピークと定義されるピーク間の間隔(時間幅)はFPD(Filed Potential Duration)とよばれ、細胞内記録でのAPD(Action Potential Duration; 活動電位幅)に相当します。薬剤によるそのFPDの延長作用は、臨床場面における薬剤の催不整脈作用を予測する上での代替指標と見なされており、ヒトiPS細胞由来の心筋細胞を用いてさかんに実験が行われています。

- MED プレート(MED-Q2430L)の1ウェル上に培養されたヒトiPS細胞由来心筋細胞の単層シート様標本。MED プローブで広く行われている播種プロトコールと同様に30000 cells/ 2ulで播種。
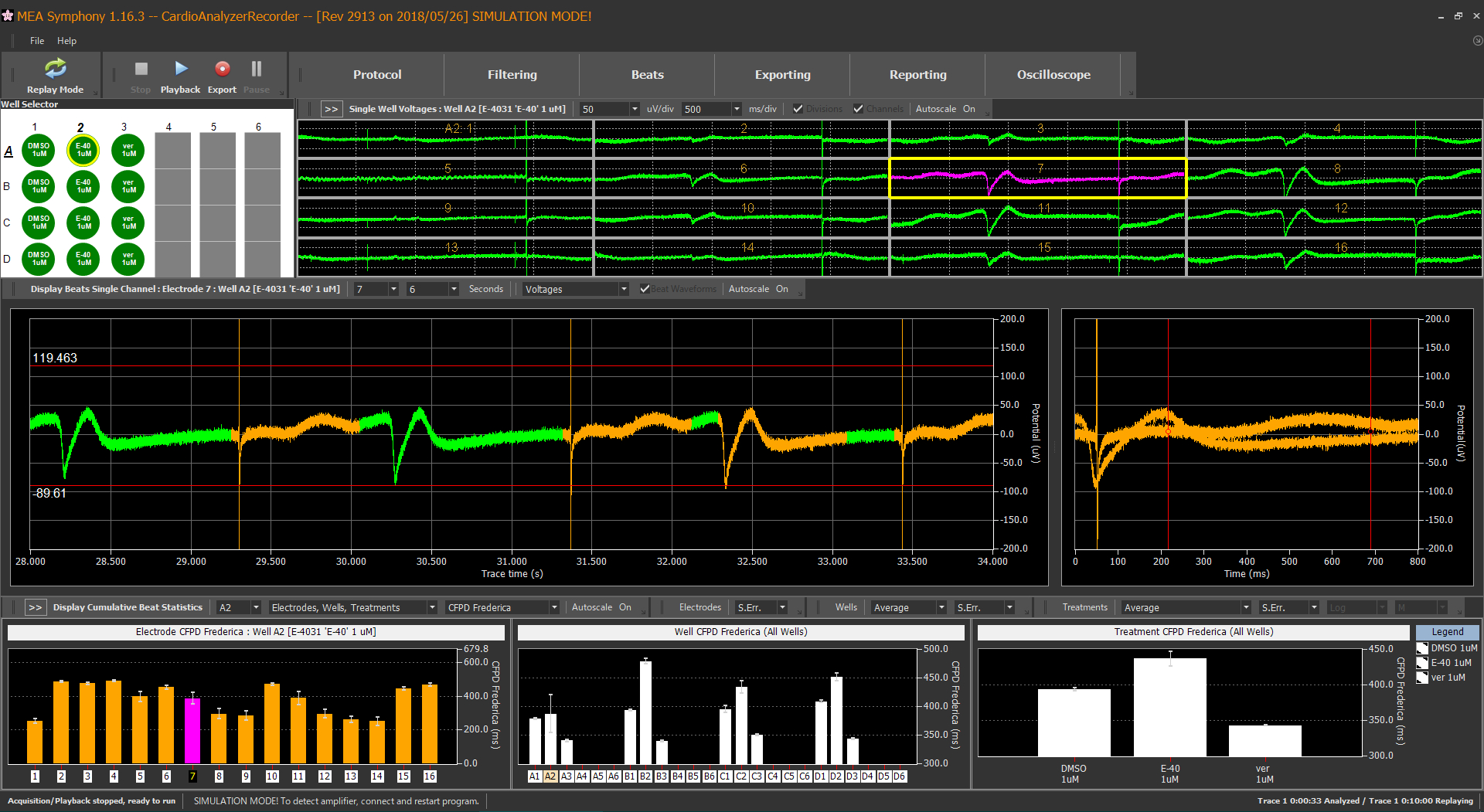
- MED64 Symphonyのメイン画面表示。上段には選択ウェルの各電極の生波形チャート、中段には選択電極の生波形チャート及び検出した1拍動ごとのFP波形を表示。下段左には表示中のウェルの各電極ごとの測定パラメータ(本例では補正FPDの拍動平均)、中央には各ウェルごとの測定パラメータの代表値(本例では任意選択した電極の値)、右には任意にウェルグループの測定パラメータの代表値を示す。DMSO群(左グラフ)に対し、E-4031群(中央グラフ)の補正FPDが延長し、verapamil群(右)が短縮する結果が得られた。各段に表示する図表はBPMのタイムチャート等、任意変更も可能。

- 実験協力
大中 浩貴 様、佐治 大介 様
日精バイリス株式会社
消化管筋層組織単離標本
胃や小腸等の消化管組織を単離して切開後、粘膜を剥離して筋層と漿膜のみの標本を作製し、~34度下で0.1 Hzのハイパスフィルター設定の下で自発活動を計測すると、消化管の部位ごとに異なる特徴を示す自発活動が観察されます。その波形にはCaチャネルの薬理的阻害下でも発生する成分も含まれ、カハール介在細胞が発生するペースメーカー電位と考えられます。

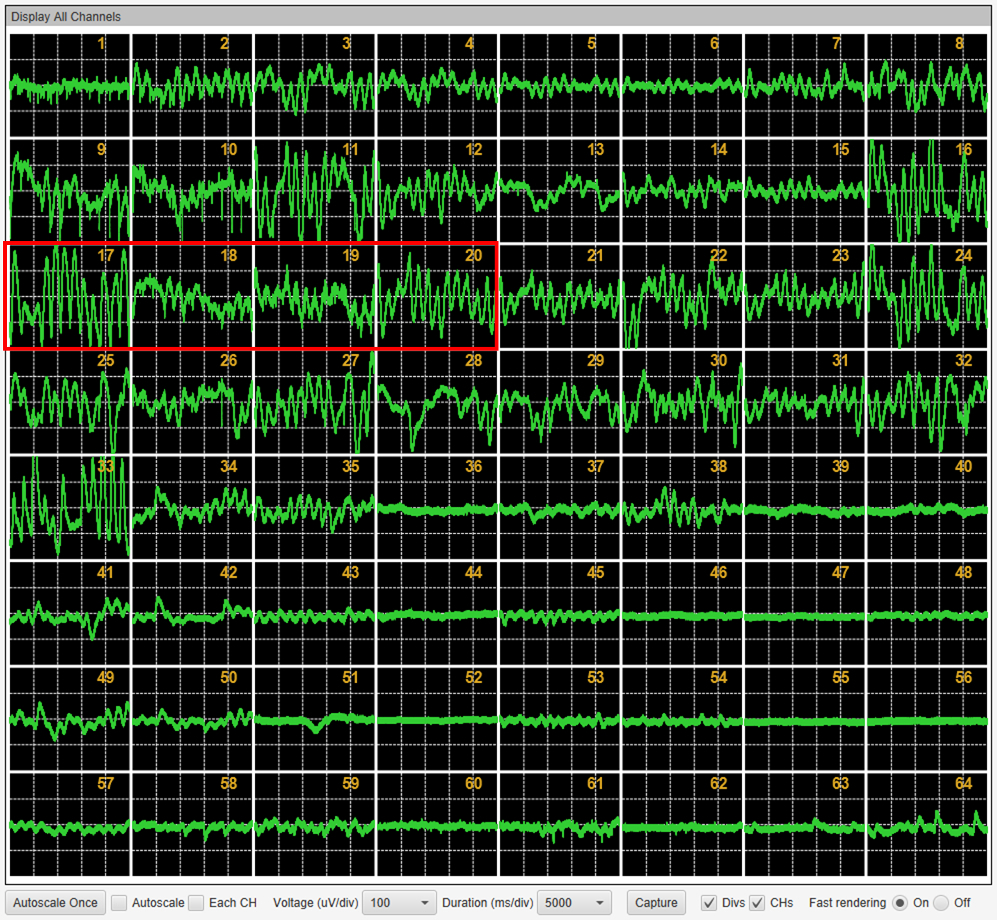
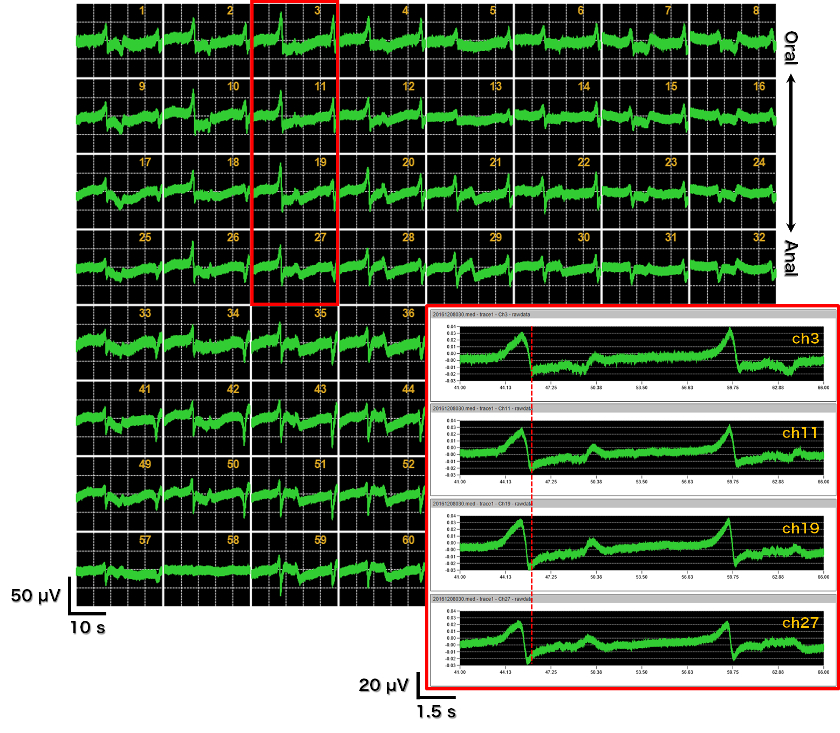
- MED プローブ(MED-P515A)上のマウス回腸筋組織単離標本。透析膜(分画分子量12000)と筋層組織標本をスライスアンカーのワイヤーに織り込むように固定し、電極へマウントする方法(透析膜法)によって電位の取得率が向上し、その振幅も大きくなる。
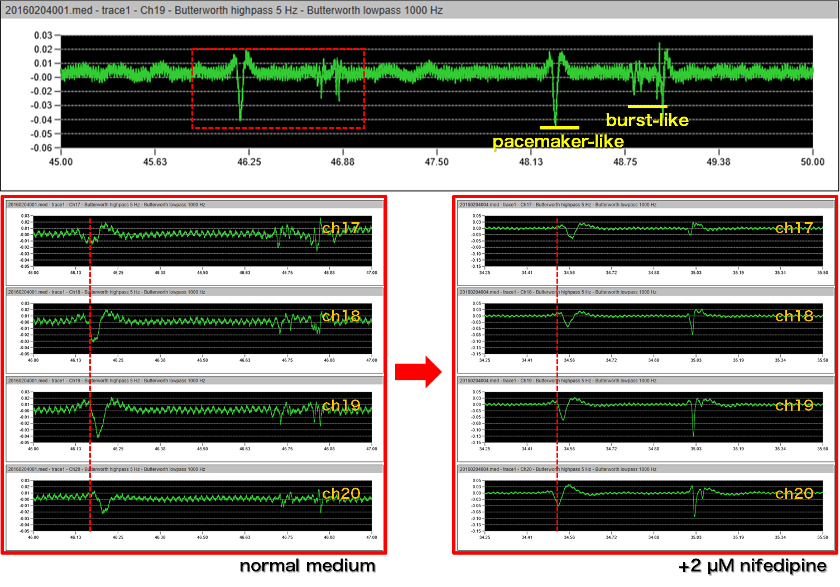
- 64チャンネル画面の赤枠で囲んだch17-20を拡大表示。5-1000 Hzのバンドパスフィルター処理を適用すると、回腸では特徴的な揺らぎ電位とバースト様電位が観察される。ジヒドロピリジン系カルシウム拮抗薬であるニフェジピンを適用するとバースト様電位が抑制され、揺らぎ電位が残る。前者は平滑筋細胞由来のカルシウムスパイク、後者はカハール介在細胞由来のペースメーカー様電位と考えられる。
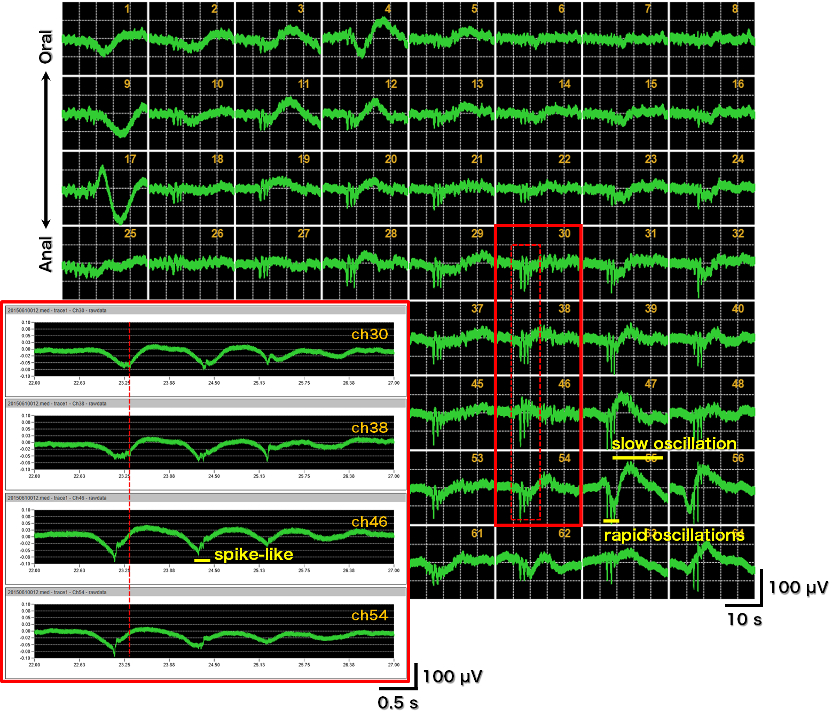
- 結腸の電位の64チャンネル画面表示(0.1-10000 Hz)。数秒にわたる遅い揺らぎ成分と1-2 Hzの周期で発生する速い揺らぎ成分、そしてスパイク様電位の3成分からなる特徴的な波形を示す。透析膜法によって初めて計測が実現した。今後のさらなる電位発生パターンの解析や病態モデルとの比較等により、新たな評価試験の確立が期待される。

- データ提供
中山 晋介 准教授
名古屋大学大学院医学系研究科 細胞生理学/分子動態学